今日は、またCOVID-19のワクチンに関する話をしようと思います。先日のブログで私は、UpToDateを参考に、世界中で承認されているCOVID-19ワクチンの紹介をしました。実はそのうちロシア製のスプートニクV(Sputnik V, 又の名をGam-COVID-Vac)の第3相臨床試験に関する疑問が2021年5/12にLancetへ投稿されていたそうです(https://doi.org/10.1016/S0140-6736(21)00899-0 )。
その"correspondence"でBucciらが挙げた疑問点は、以下の通りです。
① Spitnik Vの第1/2相試験の結果のデータに疑問点があったので、生のデータの提供を求めたが返事がなかった(その後第1/2相試験の論文は修正された)。なおSputnik Vの研究者らは「臨床試験が完了し, 尚且つ ロシアの保安当局を含む利害関係者の許可が無い限り、データを公開することはできない」と述べている。
② Sptnik Vの研究者らは、「2020年11/5に、この臨床試験へ3つのinterim analysisを追加した」と述べているが、ClinicalTrials.govにこの変更は記録されていない。また、この臨床試験のprotcolは完全公開されていないので、この変更が行われた理由が不明である。
③ ClinicalTrials.govの記録によると、2020年9/17にはSputnik Vの臨床試験のprimary outcomeが変更されている。当初、primary outcomeはワクチン接種1回目の後に評価する予定であったが、変更後は接種2回目の後に評価することになった。Sputnik Vの第3相試験結果の論文において、primary resultはこの変更に従って記載されているが、変更の理由は依然不明である。加えて、2021年2/22時点でClinicalTrias.gov上の記載では、primary outcomeの定義が「接種1回目以後において、対象者に占めるpercentage…接種2回目以後において、対象者に占めるpercentageに基づく…("Primary Outcome Measures: percentage of trial subjects...after the first dose...besed on the percentage...after the second dose")」と、矛盾する記載になっている。
④ Primary outcomeの定義が不明瞭であり、「COVID-19を疑った場合、臨床試験参加者は『PCRを含むCOVID-19診断protcol』による評価を受けた」とする記載はあるが、COVID-19疑い症例を定義する臨床パラメーターや, 使用した診断機器, PCRを実施した時期等の重要な情報が欠落している。
⑤ Sputnik V第3相試験結果の論文中では「35,963名がscreeningを受け, 21,977名がランダム化された(つまり、screeningからランダム化の間に13,986名が抜けている)」と記載がある一方で、2021年2/20時点でのClinicalTrials.govの記載では「臨床試験に参加登録されたのは33,758名」と記載されており、数が釣り合わない。またscreening→ランダム化の間に参加者が抜けていった理由についての情報もない。
⑥ Sputnik V第3相試験の論文のFigure 2において、第20日におけるワクチン群のデータが、第10日のそれよりも多い人数を含んでいた(なお2021年2/20に問題の図は修正されているが、理由は公表されていない)。
⑦ AppendixのTable中において、ワクチン接種群の年齢別コホートで報告されている参加者数が、全体の合計と一致しない。
⑧ Primary outcomeのsubgroup analysisの結果で奇妙な結果が出ており, また、appendixの結果にも極めて偶然性が高い結果が出ている。
まとめると、1. 論文を作成した本人らが、生データやprotocol全てを公開していない, 2. 臨床試験のやり方や, 一度公開したデータへ途中で(or後で)変更を加えているが理由が不明で、あやふやな所がある, 3. 数や統計が釣り合わない, といった矛盾点が出た、ということでしょう。
せっかくなんで、問題の論文"Safety and efficacy of an rAd26 and rAd5 vector-based heterogous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia."(Logunov D, Dolzhkova IV. et al., Lancet 2021;397:671-681)の内容をここで、特に上記のcorrespondanceで指摘された部分(というより、私がちゃんと読むand/or翻訳する気になった部分)に焦点を絞りつつ紹介してみようと思います。
(1) Method
① Study Design: ランダム化二重盲検化プラセボコントロールの第3相試験。モスクワ市内の病院・polyclinic合計25箇所で実施した他施設試験でもある。参加者は、ワクチン接種群:プラセボ群=3:1の比率でランダム化された。
② PICO
1. Patient selection; 18歳以上, HIV・HCV・HBV・梅毒陰性, IgM及びIgG抗体検査とPCRでSARS-CoV-2陰性, COVID-19の既往なし, 参加登録前14日間にCOVID-19患者と接触していない, 避妊することに同意あり, 尿検査で妊娠否定, ドラッグ・アルコール検査陰性, ワクチンによる過敏症の既往なし, 参加登録前14日間に急性感染症or急性呼吸器疾患に罹患していない, 人が臨床試験に参加登録可能。
一方で、参加登録の30日前にワクチン接種した, 参加登録30日前にステロイドor免疫グロブリンを投与された, 参加登録3ヶ月前に免疫抑制剤を投与された, 妊娠中or授乳中, 参加登録の前年に急性冠症候群or脳卒中に罹患, 結核or慢性全身性感染症, 薬剤などへアレルギーor過敏症あり, 悪性腫瘍, 参加登録2ヶ月前に献血を受けている, 脾摘後, 参加登録6ヶ月前に好中球減少・顆粒球減少・大量出血・重症貧血・免疫不全いずれかに罹患, HIVor梅毒orHCVorHBVいずれかによる活動性の感染症あり, 注射部位に大きな刺青あり, 食欲不振症orタンパク欠乏症, 他の臨床試験に参加中, 臨床試験に参加している施設ないしそれ以外でも臨床試験に直接関係している職員orその家族, アルコールor薬物依存症の既往あり, 他に医師が臨床試験への参加が不適とみなした場合, のいずれかに該当した人が除外された。
2. Intervention: ワクチン接種を行われたグループ。1回目は組換え型複製不能アデノウイルス(recombinant replication-deficient adenovirus; rAd) type 26(rAd26)を筋注し, 21日の間隔をおいて2回目は組み換え型アデノウイルス type 5(rAd5)を筋注した。
3. Comparison: プラセボを、上記同様に21日の間隔をおいて筋注した。
4. Outcome: 以下の2項目を評価した。
1) Primary outcome; 1回目の摂取後21日にPCRでCOVID-19と診断された参加者の割合
2) Secondary outcome; COVID-19の重症度, 各種抗体(抗SARS-CoV-2 glycoprotein S抗体, SARS-CoV-2中和抗体)値の変化, 抗SARS-CoV-2 N-protein抗体を持つ患者の割合, 抗原特異的細胞性免疫の変化, 有害事象の発生及び重症度
参加者は1回目の摂取後から28日, 42日, 180日後に経過観察の為の訪問を受けた他、2回目接種時には診察と共にCOVID-19 PCR検査を受けた。呼吸器感染症の症状が無い参加者は、PCR検査の結果が出る前に第2回接種を受けた。もし後ほどPCRで陽性となった場合、その参加者は無症状と分類され, efficacy analysisではCOVID-19症例にカウントされなかった。一方、第2回接種時に呼吸器感染症の症状があり, 尚且つ PCR検査でCOVID-19陽性だった場合、第2回目は接種せず, 治療のため医療スタッフに紹介された。
スポンサーが追加の経過観察を遠隔医療の形で手配した。全ての参加者は、同意書に署名する時に臨床試験チームと連絡を取ることができ, また主に有害事象によると思われる症状がある時に必要に応じて連絡することができた。加えて全参加者へ、健康状態監視の為にスマートフォンへ電子日記をインストールするよう求められた(このデータは電子カルテシステムに反映され、臨床試験チームはこれにより参加者の健康状態を把握できた)。COVID-19を疑った際には、参加者はモスクワの中央研究室でのPCR検査を含めたCOVID-19診断protcolに従って評価を受けた。
血液サンプル採取はワクチンorプラセボ接種直前に行われたが、免疫原性評価目的のサンプル採取は一部の施設でしか行われなかった(検体を中央の研究室に配送する経路を考慮したため)。
このSptnik Vはベクターワクチンであり、rAd26及びrAd5はいずれもSARS-CoV-2のglycoprotein Sの遺伝子を持っている。
(2) Result
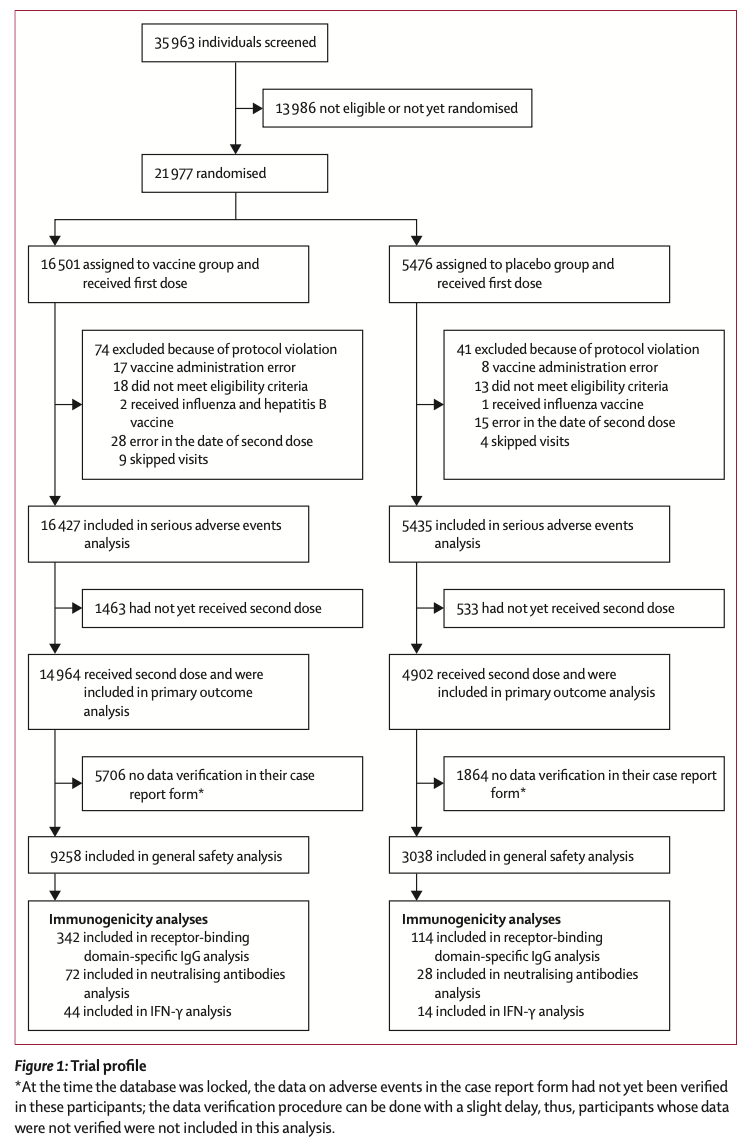
2020年9/7〜11/24の間に21,977名が参加可能となり、プラセボ群へ5,476名・ワクチン群へ16,501名がランダム化された(Figure 1)。
20例のCOVID-19症例が確認された2020年11/18に、1回目のdatabese lockが行われた。この時のデータを基にして、interim safety analysis(稀な有害事象の解析)が行われた。2回目のdatabese lockは、78例のCOVID-19症例が確認された2020年11/24に行われ, このデータを基にしてinterim efficacy analysis及び重症有害事象の解析が行われた。
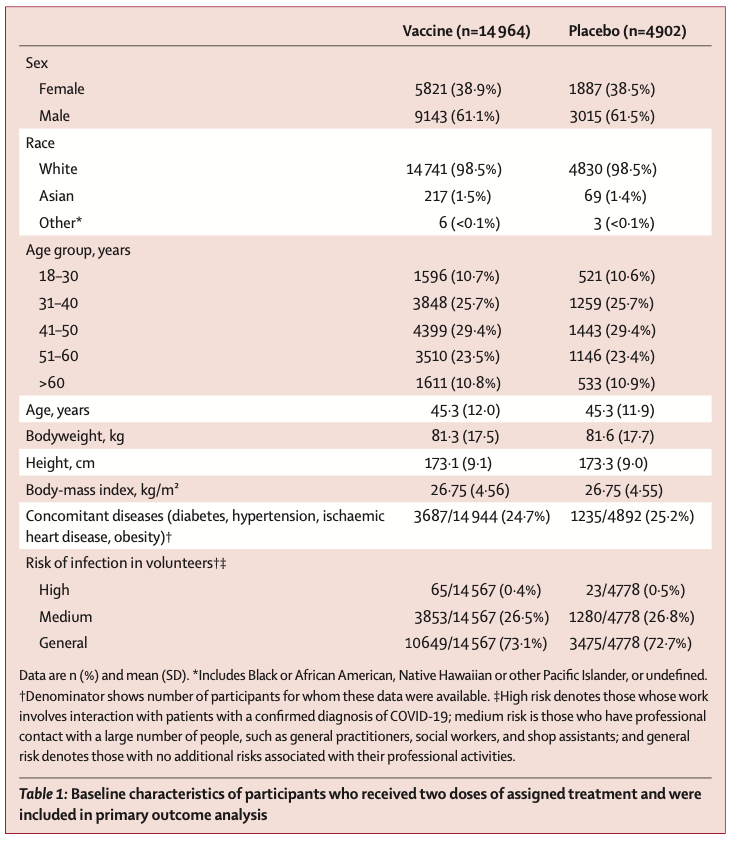
このpreliminary analysisには、少なくとも2回のうち1回の接種を受けたワクチン群 16,427名・プラセボ群 5,435名が含まれている。2020年11/24のdatabese lockの時点で、ワクチン群 14,964名・プラセボ群 4,902名がprimary outcome analysisに含まれた(Table 1)。
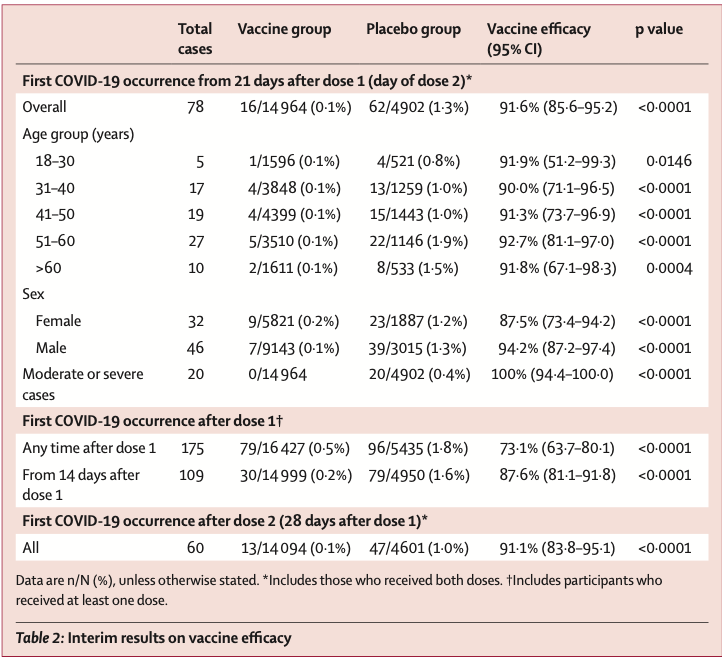
第1回接種から21日目(=第2回接種日)においてCOVID-19と診断されたのは、ワクチン群 16名/14,964名(0.1%)・プラセボ群62名/4,902名(1.3%)であり、efficacyは91.6%(95%CI 85.6-95.2; Table 2)だった。全ての年齢・性別subgroupにおいて、efficacyは87%を超えていた。特記すべきことに、60歳超の参加者でのefficacyは91.8%だった。第1回接種から21日以上経過した時点において、中等症or重症COVID-19と診断された症例はワクチン群で0名・プラセボ群で20名であった。つまり中等症or重症COVID-19に対するefficacyは100%だった。
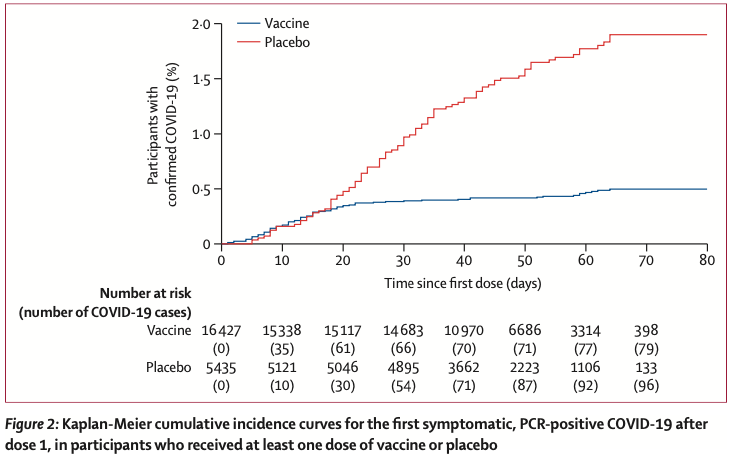
第1回接種から21日後よりも早い時期に発生した為、COVID-19診断症例97名(ワクチン群63名, プラセボ群34名)はprimary endpointの解析に反映されなかった(Table2, Figure 2)。第1回接種以後のいかなる時期において発生したCOVID-19に対するefficacyは73.1%と推計された(95%CI 63.7-80.1)。特記すべきことに、ワクチン群において、大半のCOVID-19症例が第2回接種より前に発生していた。第1回接種後およそ16~18日まではワクチン群・プラセボ群双方の間でCOVID-19発症率は類似していたが、それより後の時期では、ワクチン群の方がプラセボ群よりも増加が緩やかとなっていた(Figure 2)。
General safetyと稀な有害事象の解析の対象となったのは12,296名であった。最も多い有事象はインフルエンザ様症状, 注射部位の反応, 頭痛, 無力症であった。報告のあった有害受事象の大半(7,485名/7,966名[94.0%])がgrade 1であり, grade 2は451名(5.66%), grade 3は30名(0.38%)であった。
重症有害事象の解析には21,862名が含まれた。68名の参加者における、COVID-19と関連性のない70の重症有害事象が記録された: ワクチン群は45名/16,427名(0.3%), プラセボ群は23名/5,435名(0.4%)だった。どの重症有害事象もワクチンと関連性無しと判断された。
臨床試験の期間中、全体で4例の死亡が記録された: ワクチン群で3名/16,427名(<0.1%), プラセボ群で1名/5,435名(<0.1%)だった。ワクチンに関連した死亡の報告は無かった。ワクチン群での死亡例の内訳は、1名が胸椎骨折と関連した死亡, 2名がCOVID-19と関連した死亡(1名は第1回接種の4日後に発症し、重篤な心疾患背景を有していた。もう1名は第1回接種の5日後に発症し、内分泌疾患背景を有していた)であった。COVID-19潜伏期間を考えると、この2名の死亡した参加者は、ワクチン1回目接種時には既に感染していたと考えられる(なお第1回接種前のPCRは2名とも陰性だった)。プラセボ群の死亡は出血性脳卒中と関連していた。
(3) Discussion
この臨床試験において、Sputnik VはCOVID-19に対して91.6%のefficacyを示した。また重症COVID-19に対してのefficacyは100%だったが、これはsecondary outcomeであり, 故にこの結果はpreliminaryである。ワクチン群16,427名中、45名(0.3%)のみで重症有害事象が報告され, ワクチンと関連なしと判断されており、ワクチンの安全性は十分と思われた。Study designに則り、ワクチンのefficacyの推定の為のCOVID-19症例のカウントを開始した時期は第1回接種か21日後とした。この試験は単回投与regimenのefficacyを評価する為に設計されていないものの、早期開始によって、単回投与による部分的な保護効果の可能性を観察することができた。第1回接種後にプラセボ群とコントロール群の間で累積COVID-19発生曲線は分かれ始めており、第1回接種後に部分的な保護効果が早期に発生したことが示された。しかしながら、study designのせいで、これらの観察結果より結論を導き出すことはできない。
なお、ここで示した論文の翻訳は一部だけであり、特に「細胞性免疫や抗体がなんちゃら」という部分のresultやdiscussionはガン無視してしまいました(笑)申し訳ありません!なおこの論文の文中で「特にCOVID-19症例に着目して綿密なモニタリングを続けている」との記載があること, 小児・思春期集団での効果検証の必要性への言及があることや, 単回接種regimenの臨床研究が進行中であるとの記載もあることから、Sputnik Vに関してはまだデータが出揃っていないと考えた方が良いのでしょうか。