せっかくなんで新型コロナウイルスに関する論文を読んでみた。 Part 7
NEJMでSARS-CoV-2/COVID-19に関する新しい論文が出たので紹介します。今年3月18日に公開された論文"A Trial of Lopinavir-Ritonavir in Adults Hospitalized with Severe Covid-19"(Cao B, Wang D. et al.)です。
(1) Introduction
2003年にSARSが流行した後、lopinavir(HIV type 1 aspartate protease inhibitor)が試験管内でSARSコロナウイルス (SARS-CoV)を抑制することが判明した。またritonavirをlopinavirと組み合わせると、cytochrome P450の抑制を介して血清中の半減期を延長する。2004年に発表されたopen-label studyは、ribavirinのみを投与したcontrol群と比較して、lopinavir-ritonavir(それぞれ400mgと100mg)とribavirin併用群は、悪化した臨床転機(ARDSもしくは死亡)のriskとウイルス量を減少させた。しかし、ランダム化の不足や, ribavirin・グルココルチコイドとの併用は、lopinavir-ritonavirの効果を評価するのは難しい。同様にして、MERSコロナウイルス(MERS-CoV)に対してlopinavirが試験管内・動物モデルで活性があり, lopinavir-ritonavirをribavirin・interferon αの併用によりウイルスの排除と生存に繋がったとする症例報告がある。しかしながら、ヒトにおける本治療法の効果に関する説得力あるデータが乏しく、MERSに対するrecombinant interferon β-1bの臨床試験が現在進行途上である。
今回、本研究ではSARS-CoV-2感染に対するlopinavir-ritonavirの経口投与の効果と安全性を評価するため、ランダム化コントロールopen-label trialを行った("LOTUS China"[Lopinavir Trial for Suppression of SARS-CoV-2 in China])。
(2) Method
① Patient Selection
2020年1月18日から2月3日の間の中国の湖北省武漢市Jin Yin-Tan Hospitalにおいて、以下のような基準を満たす患者がtrialへ登録された。
他方、以下に該当する患者は除外された。
- Trialに含めるのは患者の利益とならないと医師が判断した
- 患者がprotocolに安全に従えない全身状態である
- Lopinavir-ritonavirへのアレルギーor過敏症の既往
- 重症肝疾患(e.g. ALT>[正常値上限の5倍] or AST>[正常値上限の5倍]の肝硬変)
- Lopinavir-ritonavirとの併用が禁忌の薬剤を服用しており、置換・中止ができない
- 妊娠 or 授乳中
- 既知のHIV感染(他の抗ウイルス薬との併用がなければ、lopinavir-titonavirへの耐性を生じる可能性があるので)
これらの患者を、1:1の比でランダムに治療介入群とcontrol群へ振り分けた。また2群間での酸素療法の分布のバランスを取るため、trialへの登録時にランダム化を呼吸補助の方法(e.g. 酸素療法なし, マスクやnasal duct, 高流量酸素, 非侵襲的換気 or ECMOを含む侵襲的換気)に基づき階層化した。
② Intervention: 標準的治療に並行してlopinavir-ritonavir(400mg・100mg経口, 1日2回)を14日間継続した群
③ Comparison: 標準治療のみ14日間継続した群。なおこのtiralは非常時に行われたので、placeboは用意されていない。
④ Outcome
以下のような項目を評価した。なお以下の"seven-category ordinal scale"や安全性, 死亡に関するデータは、訓練を受けた看護師による連日の記録から取得した。また、退院, もしくは死亡するまでの間の第1日(lopinavir-ritonavir投与前)と第5, 10, 14, 21, 28日に口咽頭ぬぐい液を採取し、その検体へ定量的real-time RT-PCRを行った。
1. Primary end point; 臨床的改善が得られるまでの時間(Primary Outcome)
- ランダム化から"seven-category ordinal scale"が2点改善するまで
- ランダム化から生存退院するまで
2. その他臨床的なoutcome (Secondary Outcome)
- 第7, 14日におけるseven-category ordinal scale
- 第28日における死亡率
- 機械的換気の期間
- 治療開始〜死亡までの期間
3. ウイルス学的な評価
4. Safety outcome
- 治療中に発生した有害事象
- 重篤な有害事象
- 治療の中断
(3) Results
① Patients
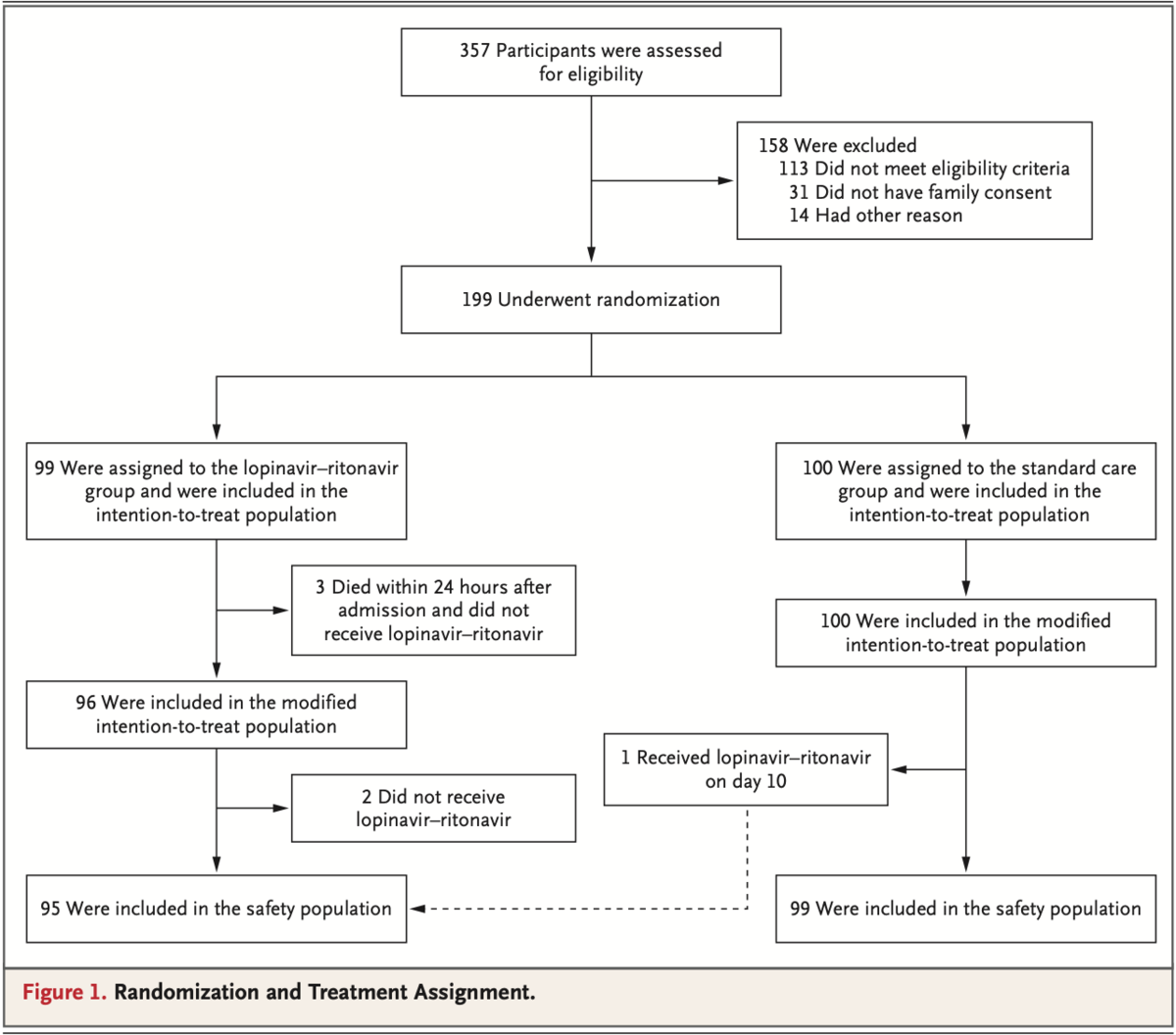
199名の患者がランダム化され、うち99名はlopinavir-ritonvir群, 100名が標準的治療のみの群へ加えられた。Lopinavir-ritonavir群のうち94名(94.9 %)が薬剤投与を受けた(Figure 1)一方で、5名は受けなかった(3名; ランダム化後24時間以内に死亡, 2名; 別の理由)。
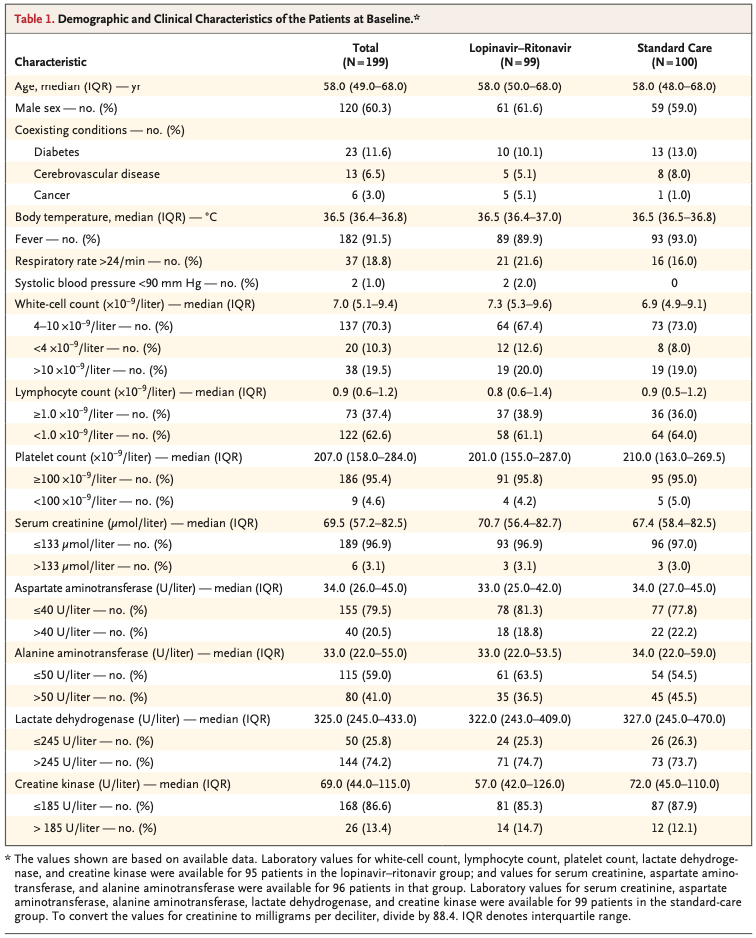
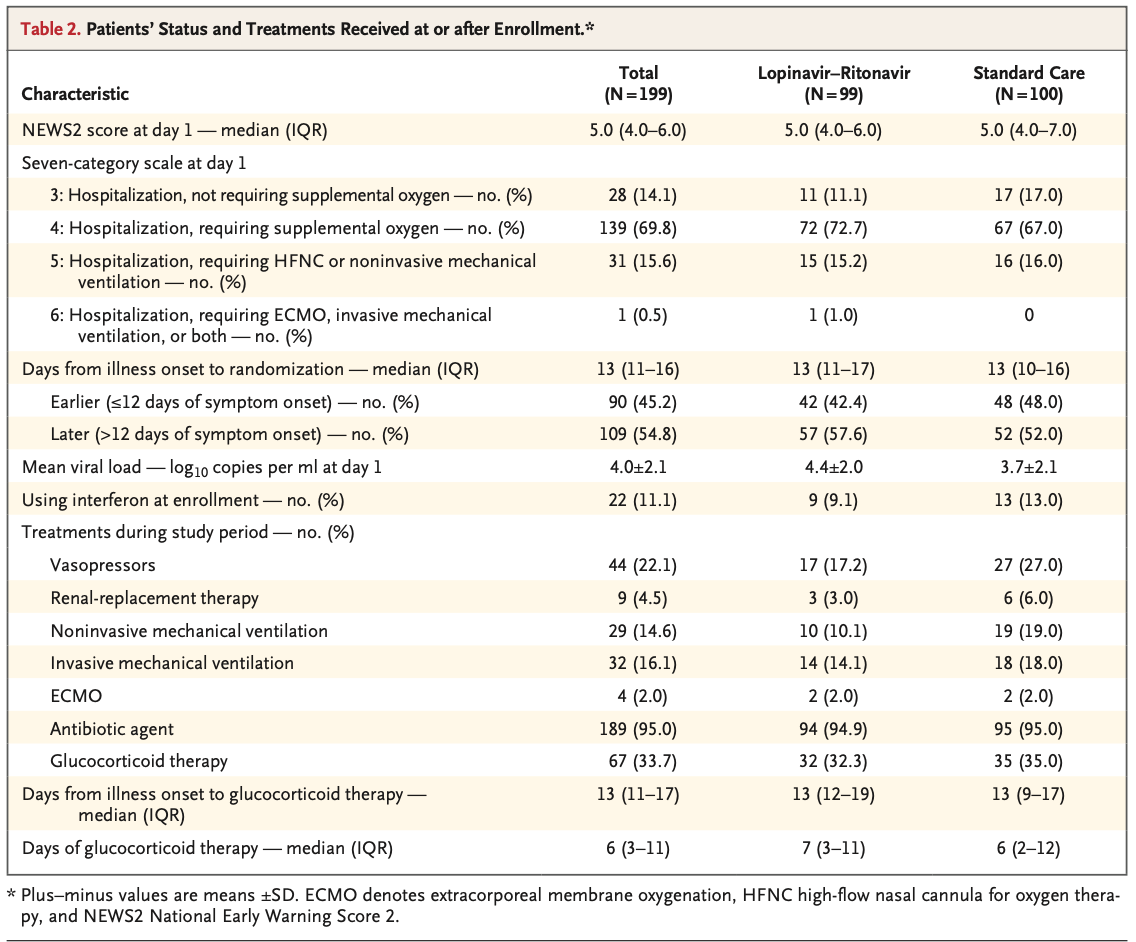
なお患者年齢中央値は58歳(interquartile range[IQR] 49~68)で患者の60.3 %は男性であった(Table 1)。また発症〜ランダム化までの期間の中央値は13日(IQR 11~16日)だった(Table 2)。またグループ間で人口統計学, baselineの検査データ等の重要な項目に関する差異はなかった。またtrial期間中、lopinavir-ritonavir群の33.0 %, 標準治療群の35.7 %でグルココルチコイド療法が行われた。
② Primary Outcome

Intention-to-treat分析(以下、ITT分析; 両群でランダム化後に脱落した人も含めて分析すること。本trialの場合、lopinavir-rotpnavir群で抗ウイルス薬投与を受けなかった5名を含めた)では、lopinavir-ritonavir群と標準治療群間で改善までの期間は差がなかった(中央値; 16日 vs 16日; 臨床的改善のhazard ratio 1.31; 95%CI 0.95~1.85, P=0.09)(Figure 2)。また途中で抜けた人を除外した分析(modified ITT分析)では、lopinavir-ritonavir群での臨床的改善までの期間の中央値が15日だったのに対し、標準治療群では16日だった(hazard ratio 1.39; 95%CI 1.00~1.91)。
他に、ITT分析において、発症後12日以内におけるlopinavir-ritonavir治療は臨床的改善までの期間短縮に関連していた(hazard ratio 1.25; 95%CI 0.77~2.05)が、より遅い治療は関連していなかった(hazard ratio 1.30; 95%CI 0.84~1.99)。加えて、2群間で臨床的悪化("seven-category scale"における1 categoryの増加)を比較したが、差は見られなかった(hazard ratio 1.01; 95%CI 0.76~1.34)。
③ Secondary Outcome
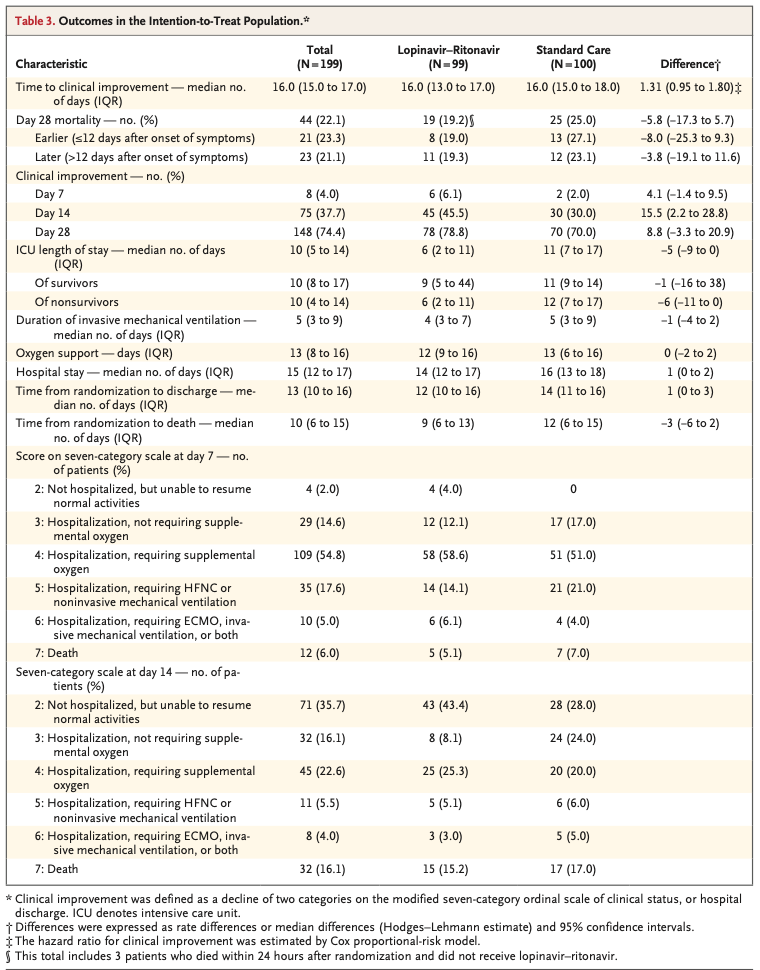
ITT分析とmodified ITT分析のいずれにおいても、28日目の死亡率は標準治療群と比較してlopinavir-ritonavir群で数値上低かった(ITT分析: 19.2 % vs 25.0 %; difference -5.8 percentage points; 95%CI -17.3~5.7, modified ITT分析: 16.7 % vs 25.0 %; differece -8.3 percentage points; 95%CI -19.6~3.0) (Table 3)。
他にlopinavir-ritonavir群では以下のような結果が見られた。
- 標準治療群と比較してICU滞在期間が短い(中央値 6日 vs 11日; difference -5日; 95%CI -9~0)
- ランダム化〜退院までの期間が数値上短い(中央値 12日 vs 14日; difference 1日; 95%CI 0~3)。
- 第14日に臨床的改善があった患者の割合が多い(45.5 % vs 30.0 %; difference 15.5 percentage points; 95%CI 2.2~28.8)
なお他の評価項目(酸素療法の期間, 入院期間, ランダム化~死亡までの期間)は有意差が見られなかった。
④ ウイルス学的評価
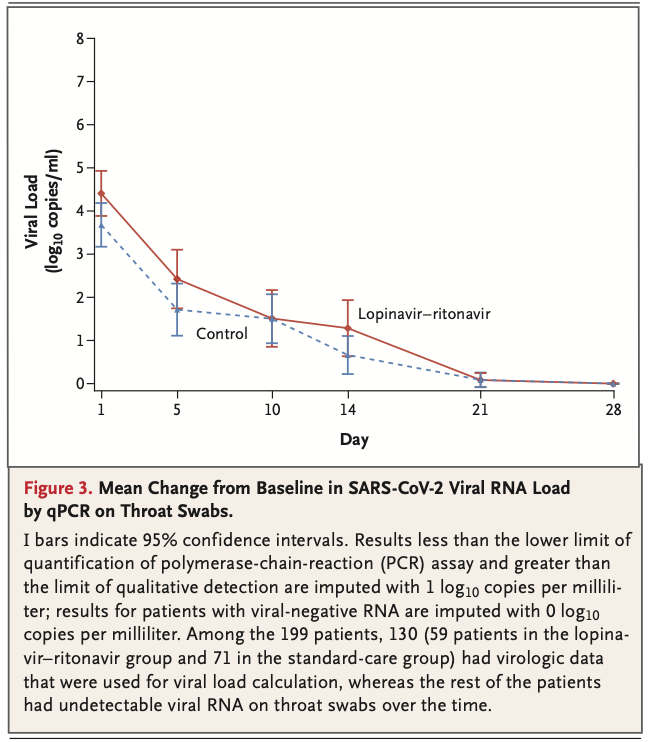
呼吸器サンプルへのRT-PCRで陽性だった患者のうち69名(35 %)が、trial参加への同意取得後に採取した咽頭ぬぐい液へのRT-PCR結果陰性だった。同意後に採取した咽頭ぬぐい液のbaselineのウイルスRNA量の中央値(±SD)は、標準治療群と比べてlopinavir-ritonavir群でわずかに高かった(4.4±2.0 log10 copies per milliliter vs 3.7±2.1) (Table 2)。但し、経過中のウイルスRNA量は両群間にて差はなかった(Figure 3)。
また、SARS-CoV-2のRNAを検出できた患者の割合は、どのサンプル採取日においても両群間で類似していた(lopinavir-ritonavir群 vs 標準治療群; 第5日 34.5 % vs 32.9 %, 第10日 50.0 % vs 48.6 %, 第14日 55.2 % vs 57.1 %, 第21日 58.6 % vs 58.6 %, 第28日 60.3 % vs 58.6 %)。
⑤ 安全性
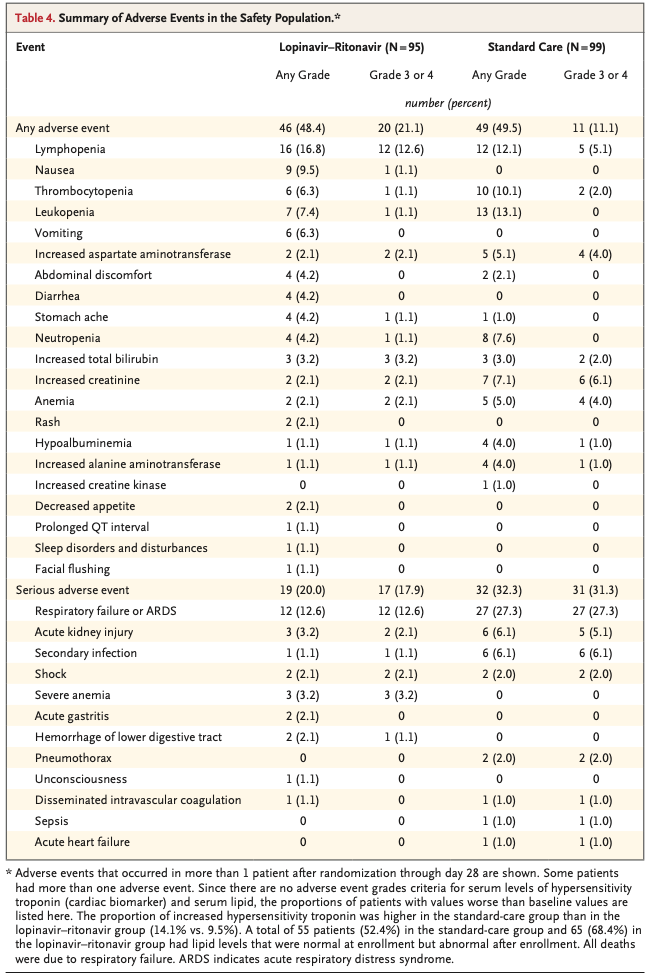
Lopinavir-ritonavir群の46名(48.4 %), 標準治療群の49名(49.5 %)にて、ランダム化〜第28日の間における有害事象が報告された(Table 4)。消化管系の有害事象(吐き気, 嘔吐, 下痢)が標準治療群よりlopinavir-ritonavir群で多く見られた。また重篤な有害事象は51名(lopinavir-ritonavir群; 19, 標準治療群; 32)で見られた。また呼吸不全, 急性腎傷害, 2次感染は標準治療群でより多く見られた。
(4) Disucussion
本trialでは以下の知見が得られた。
- 重症COVID-19患者における標準治療 + lopinavir-ritonavirの治療は臨床的改善, もしくは 死亡率と関連性が無かった。
- しかしmodified ITT分析(lopinavir-ritonavir群の死亡した3名を除外)では、臨床的改善までの期間の中央値にわずかながら有意差を認めた(15日 vs 16日)。
なお本trial全体の死亡率(22.1 %)は、COVID-19で入院した患者に対する初期の記述的研究において報告された死亡率11~14.5 %より高いため、重症患者を登録したことが示唆される。
本trialのstudy populationは、登録時の発症からの時間と重症度を考慮すると不均質である。発症後12日以内に治療を受けたsubgroupにおいて臨床的改善の加速(lopinavir-ritonavir群 vs 標準治療群; 16.0日 vs 17.0日)と死亡率の低下(19.0 % vs 27.1 %)が見られたものの、それより遅く開始された場合はそれが見られなかった。「COVID-19における早期のlopinavir-ritonavir治療開始には臨床的な利益があるか」という疑問には、更なる研究が必要である。また本研究の知見は、1. SARS-CoV-2による肺炎患者において、発症後2週間に病勢の進行があったと示した研究, 2. 過去のSARS, 重症インフルエンザへの抗ウイルス薬投与を行ったstudyで時間・治療効果(time-to-treatment effect; 「治療が早めに始まるほど改善があった」ということ)を認めた研究, と一致する。加えて、lopinavir-ritonavir治療群は、標準治療群と比較すると重症合併症がある患者, もしくは 非侵襲的or侵襲的機械的換気を要する呼吸不全の患者が少なかった。これらの観察結果からは仮説を導き出すことができ、特定の病期においてlopinavir-ritonavirを投与することでCOVID-19の合併症を減らすことが可能かどうかを判定する追加の研究が必要である。
標準治療群と比較して、lopinavir-ritonavirを追加した群でウイルスRNA量, もしくは ウイルスRNAを検出できる期間が減少したという知見は得られなかった。Lopinavor-ritonavir治療群の40.7 %では、trialの最後(第28日)でもSARS-CoV-2 RNAが検出され続けていた。最近の研究では、重症のCOVID-19患者ではウイルス放散期間の中央値が20日であり、最長で37日にもなり得た。本trialと過去の研究ではいずれも、lopinavir-ritonavirが有意な抗ウイルス作用を発現させていたという証拠は示されなかった。これの明確な原因は不明確だが、本trialにおけるサンプル採取法が適当で無かったことによる可能性が大きい。例えば本trialではサンプル採取が間欠的(第1, 5, 10, 14, 21, 28日に採取)であり, 最初の5日間でより頻繁にサンプル採取を行えば、急性期における両群のウイルス量のkineticsのより詳細な特徴が判明する可能性があった。更に、重要なことだが、本trialでは下気道検体を採取できていない。試験管内のSARS-CoVに対するlopinavirの50 % effective concentrations (EC50)は4.0~10.7 μg/mLである(他の研究ではlopinavirは無効, ないし 25 μg/mL必要であった, と報告)ことは記憶に値する。またMERS-CoVの場合、EC50は5~約7 μg/mLであった。成人におけるlopinavirの血清濃度のピーク値(9.6 μg/mL)とトラフ値(5.5 μg/mL)はいずれも、これらの値に到達している。EC50が妥当な閾値なのか, ヒト血清中の非結合lopinavir濃度がSARS-CoV-2の抑制に有効かどうか, は疑わしい。
14 %近くのlopinavir-ritonavir群患者が、14日間のコースを終えられなかった。これは主に、消化器系有害事象(食欲低下, 吐き気, 腹痛, 下痢, 急性胃炎)によるものである。また2名に自然治癒型の皮疹(self-limited skin eruptions)が見られた。Lopinavir-ritonavirでは、肝傷害・膵炎・より重症な皮疹・QT延長のriskを含む副作用や, CYP3A抑制による薬剤相互作用の可能性が報告されている。本trialで見られた副作用は、予後改善のためのより高用量の使用, もしくは より長期間の使用に対する懸念を生じさせた。
なお本trialでは複数のlimitationがある。
- ブラインド化がされていない。
- 両群間で患者のcharacteristicsはバランスが取られてるが、lopinavir-ritonavir群での多少高い咽頭ウイルス量は、この群でのウイルス複製が多かった可能性を提示している。
- グルココルチコイドのような薬物療法の併用は、両群間で差が見られなかったものの、これも交絡因子だったかもしれない。
- Lopinavir-ritonavir群の患者のうち、咽頭ぬぐい液でRNA陽性であった患者の割合は第14日に約45 %, 第28日に約40 %であったものの、ウイルスの分離を試みたり, もしくは lopinavirに対する感受性が減少したSARS-CoV-2変異型出現の可能性を評価しなかったため、感染性のあるウイルスが存在するかどうかは不明であった。
- 重症患者におけるlopinavir曝露濃度に関するデータを持っていない。
「抗HIV薬がいけるんじゃね?」的な『噂話』は私も職場で聞いていましたが、今回こうゆう形で論文が出ました。結論としては、「標準的な治療(低酸素に対する酸素療法, 呼吸不全に対するNPPV・人工呼吸器・ECMO, 腎傷害に対する腎代替療法etc.)をやった場合と大して変わらない。但しもう少し研究が必要だ」ということなのでしょう。