軽症〜中等症COVID-19患者へのモノクローナル抗体2剤併用療法の臨床試験
さ〜て!専門医試験勉強に飽きたからどうゆう訳か論文を読み始めた救急医のカ医ロ・レンですよぉ〜!!今日皆様に紹介するのわぁ、ことし7月14日に発表された論文"Bamlanivimab plus Etesevimab in Mild or Moderate Covid-19."(Dougan M., Nirula A. et al., New Engl J Med 2021. DOI: 10.1056/NEJMoa2102685)ですぅ〜〜〜〜!
(注:ふざけた書き出しで申し訳ありませんw)
(1) Introduction
現在、mRNAワクチン等のワクチンが出荷されている最中だが、ワクチン摂取前に症候性COVID-19に罹患, もしくは ワクチン接種にも関わらず感染した患者の治療法開発も依然重要である。中和モノクローナル抗体による即効性受動液性免疫療法は、COVID-19に関連した入院と死亡を防ぐ事に関して、可能性がある予防的・治療選択肢である。
そのような中和モノクローナル抗体の中に、COVID-19患者の回復血清から分離されたbamlanivimab(米国製)とetesevimab(中国製)の2つがある。これらはSARS-CoV-2表面スパイク糖タンパク質を標的としている。Bamlanivimabは、AbCellera Biologicsと,国立アレルギー・感染症研究所内のワクチン研究センターの研究者に発見された後, イーライリリーにより開発された。一方のEtesevimabはイーライリリー, Junshi Biosciences, 及び 中国科学アカデミー内の微生物研究所の共同研究により開発された。
Blocking Viral Attachment and Cell Entry with SARS-CoV-2 Neutralizing Antibodies(BLAZE-1)の第2相, 及び 第3相早期臨床試験の結果は、bamlanivimab・etesevimabのうちいずれかの単剤療法, 及び 2剤併用療法がCOVID-19に関係した入院と重症への進行のrisk低減に有効であることを示した。その結果、FDAは2020年11月にbamlanivimab単剤療法の緊急使用を承認したが、後に取り消した。FDAは2021年2月にbamlanivimabとetesevimab併用療法の緊急使用を承認した。今回は、BLAZE-1の第3相臨床試験の最新のデータ - すなわちCOVID-19軽症or中等症に罹患し, 重症化riskが高い思春期・成人の外来患者という集団における結果を報告するものである。
(2) Method
① Trial Design
BLAZE-1は現在進行中の第2・3相ランダム化二重盲検化プラセボコントロール単回投与臨床試験である。患者は全員、外来にて直近に軽症・中等症のCOVID-19と診断されている。患者は直接的抗原検査・核酸検出検査のいずれかによりSARS-CoV-2陽性と診断された後の3日以内に軽症・中等症COVID-19で受診した。
BLAZE-1は複数に分かれており、多くのコホート, 及び 治療群への研究を行なっている; しかし、ここではCOVID-19重症化risk factor1個以上のある思春期・成人患者からなるコホートを対象としている第3相試験の本来の部分の結果に注目する。
BLAZE-1のこの部分では、最初の患者が2020年9/4に登録され, 最後の患者は2020年12/8に登録された。患者はbamlanivimab 2,800mgとetesevimab 2,800mgの併用, もしくは プラセボのいずれかを1時間かけて投与された。
② PICO
1. Patient selection: 参加登録可能であった患者は、年齢層により以下のような違いがあった。
I. 12~17歳の歩行可能な患者のうち、screening時に以下のrisk factorのうち1個以上がある
- 年齢・性別に対応したBMIで85 percentile以上
- 鎌状赤血球症
- 先天性 or 後天性心疾患
- 脳性麻痺等の神経成長障害
- 気管切開等の医療機器・処置に依存している(但し、COVID-19と関係ないもの)
- 喘息やその他慢性呼吸器疾患
- 1型・2型糖尿病
- 免疫抑制状態 or 免疫抑制薬投与中
II. 18歳以上の歩行可能な患者のうち、以下のようなrisk factorが1個以上ある
なおここでの軽症・中等症COVID-19の定義はFDAガイドラインに則って、発熱, 咳嗽, 咽頭痛, 倦怠感, 頭痛, 筋肉痛, 消化器症状, 運動時の息切れとした。また、室内気でSpO2≦93%, PaO2/FiO2比<300, 呼吸数≧30回, 心拍数≧125に該当する患者は除外された。
2. Intervention: 上記2剤の併用療法
3. Comarison: プラセボ投与
4. Outcome: primary outcomeとsecondary outcomeはそれぞれ以下の通り。
I. Primary Outcome; 29日後までのCOVID-19に関連した入院, もしくは 死亡(死因は問わない)
II. Secondary Outcome; key secondary outcomeとadditional secondary outcomeに別れている。
1)Key secondary outcome
- Baselineから7日目の間のSARS-CoV-2ウイルス量変化
- 7日目でも高値(logウイルス量>5.27)を維持しているSARS-CoV-2ウイルス量
- 29日後までのCOVID-19関連入院・救急外来受診・死亡の複合
- 症状寛解までの期間(患者の自己申告)
2)Additional secondary outcome
(3) Result
① Patients

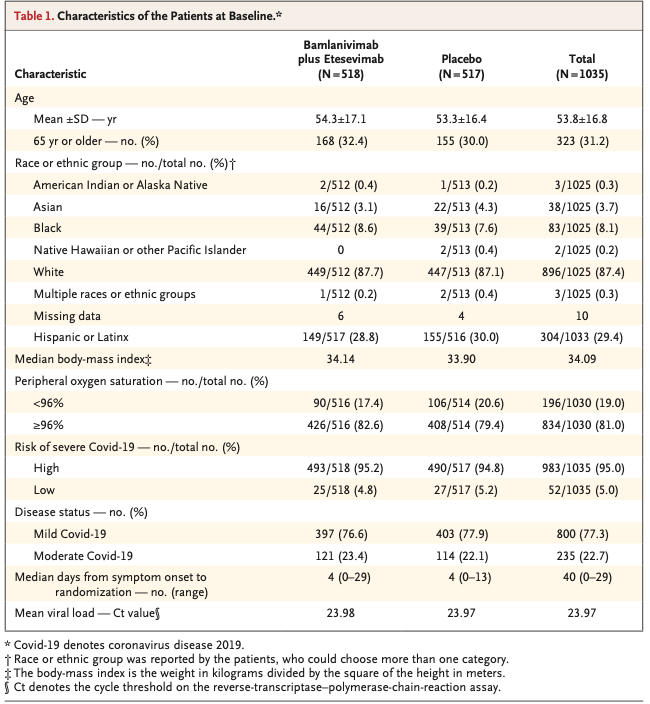
2021年1/20のデータベースロックまで、1,035名がランダムに併用療法もしくはプラセボへ割り振られた(Fig. 1)。患者(参加者)の特徴は以下のようなものだった(Table 1)。
- 平均年齢(±SD): 53.8±16.8歳, 65歳以上の患者: 31.2%
- BMI中央値: 34.09
- 思春期女性: 全体の約52.0%
- 人種: ヒスパニック・ラテン系; 29.4%, 黒人; 8.1%
ランダム化時には、77.3%の患者に中等症COVID-19症状があった。患者は、中央値で発症後4日以内に薬剤投与を受けていた。
② Primary Outcome
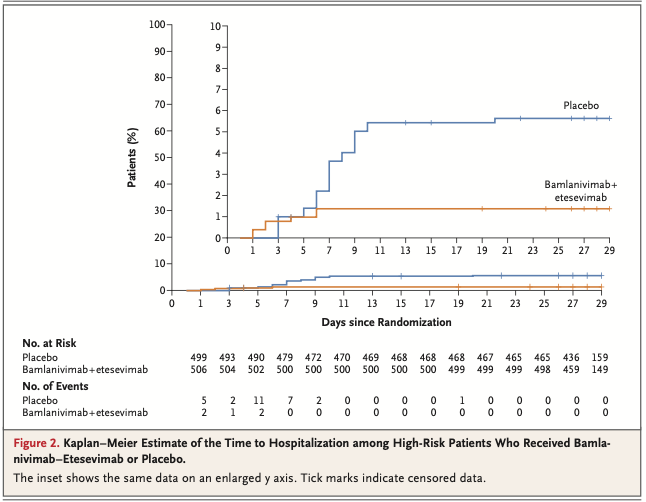
併用療法群の518名中11名で29日目までにCOVID-19関連入院ないし死亡が起こり, それに対しプラセボ群の517名中36名でそれが起きた(絶対リスク差 -4.8 percemtage point; 95%CI -7.4~-2.3; 相対リスク差 70%; P<0.001) (Fig. 2)。29日目までに、併用療法を受けた患者で死者は0, プラセボを受けた患者517名中10名が死亡した。
③ Key Seconday Outcome
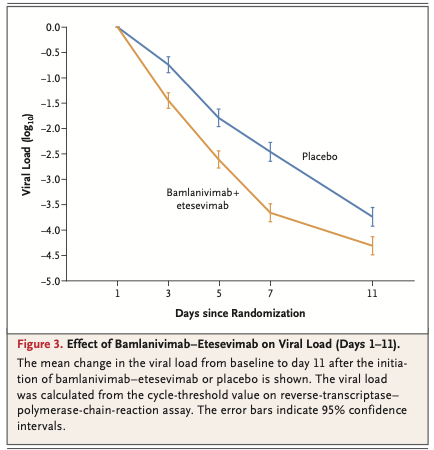
Baselineから7日目までのウイルス量減少平均値は、併用療法群がプラセボ群の約16倍であった(baselineからの減少のプラセボ群との差 -1.20; 95%CI -1.46~-0.94; P<0.001) (Fig. 3)。7日目に高ウイルス量が持続していた患者の割合は、併用療法群で9.8%(50名/508名), それに対しプラセボ群で29.5%(147名/499名)だった(差 -19.5 percentage points; 95%CI -24.4~-14.9; P<0.001)。併用療法群518名中12名(2.3%)で29日目までにCOVID-19関連入院・救急外来受診ないし死亡が見られ、一方プラセボ群は517名中37名(7.2%)でそのような転帰が見られた(baselinからの減少のプラセボ群との差 -4.8 percentage points; 95%CI -7.4~-2.3; P<0.001)。2回連続した評価を経た持続的な症状寛解までの期間の中央値は、併用群でプラセボ群よりも1日短かった(併用群 8日[95%CI 7~8] vs プラセボ群 9日[95%CI 8~10]; P=0.007)。
④ 安全性
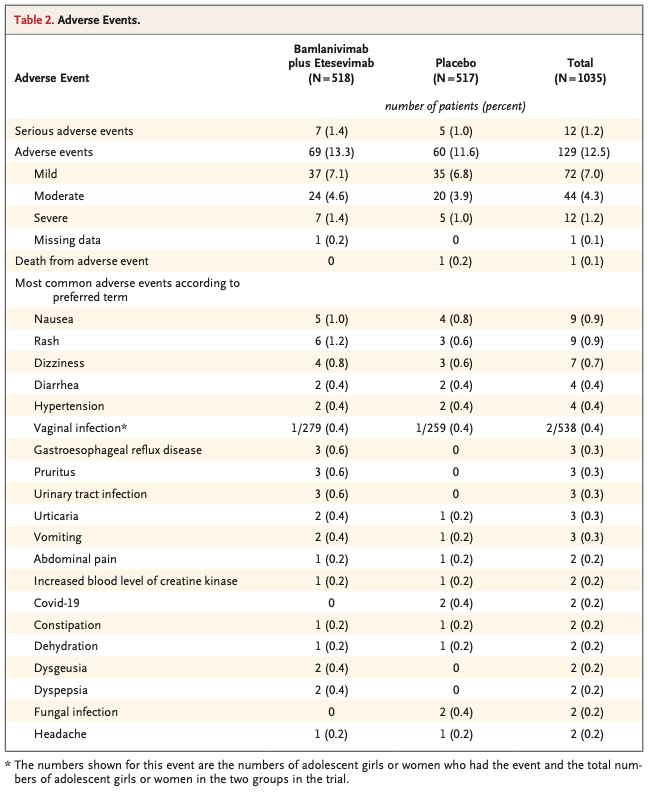
重篤な有害事象は併用療法群518名中7名(1.4%), プラセボ群517名中5名(1.0%)で発生した。点滴投与開始後に発症した有害事象は併用療法群518名中69名(13.3%), プラセボ群517名中60名(11.6%)で発生した。両群で最も多かった有害事象は吐き気, 皮疹, めまい, 下痢, 高血圧だった(Table 2)。
⑤ Exploratory Outcome
併用療法群の518名中、合計11名(2.1%)がCOVID-19で入院した。この患者群における入院期間平均値(±SD)は7.3±6.4日であった。プラセボ群ではより多くの人間がCOVID-19で入院し(33名/517名, 6.4%)、この患者群の入院期間平均値は11.2±10.1日であった。
(4) Discussion
この研究では、primary outcome及びsecondary outcomeにおいて、bamlanivimab・etesevimab併用療法はプラセボよりも臨床上・ウイルス学上のbenefitが上回っていることが見出された。
Primary outcomeを考慮すると、結果は併用療法による早期介入が入院発生に対し有効性があることを示した。29日目までのCOVID-19関連入院ないし死亡は併用療法群でプラセボ群よりも4.8 percentage poit低かった。この知見は、過去に報告されたbamlanivimab単剤療法の臨床試験結果と, 併用療法の効果を評価したBLAZE-1の第2相部分と一致する。併用療法群の患者に死者はいなかった反面、プラセボ群では10名が死亡した。死亡例の大半は男性患者で59歳以上であり, プラセボ群では高血圧が最も多い併存疾患であった。併用療法は、治療開始後4日以内でのより早期の症状寛解に繋がった。これらの知見は、中和モノクローナル抗体療法が重症化するrisk, 並びに COVID-19に罹患したhigh-risk患者における重症度の双方を減少させる可能性を支持するものである。
Bamlanivimabとetesevimab併用療法によって7日目までにSARS-CoV-2ウイルス量は減少し、これは臨床上のbenefitと一致する。ウイルス量が5.27を上回る患者の割合は、プラセボ群より併用群で低かった。7日目において、併用療法群のウイルス量減少の程度はプラセボ群の約16倍高かった。この研究でウイルス量は、臨床的outcomeと相関する可能性のあるCOVID-19のbiomarkerとなる可能性が示された。
重篤な有害事象の発生率は低く, 併用療法群(1.4%)及びプラセボ群(11.0%)で類似していた; これらの知見は、bamlanivimabとetesevimab併用療法がhigh-risk患者に使用するに当たって、容認できる安全性profileを持っていることを示している。
この臨床試験の患者から得た鼻咽頭検体へのウイルス配列解析は現在進行中である。入手可能な配列結果のうち、baselineもしくは治療後の検体中で、スパイクタンパク質中のbamlanivimabとstesevimabによる試験管中の中和能に影響することが判明している箇所に変異があったのは5%未満であった。B.1.351(ベータ)変異型やP.1(ガンマ)変異型といったウイルス変異型は、開発中の数種類のモノクローナル抗体へ試験管中で耐性を示した。報告した時点では、これら変異型はこの臨床試験において見られなかったものの、これら変異型の出現は、より広範な全世界的ウイルス監視プログラムの必要性に焦点を当てるものである。
モノクローナル抗体の投与に当たっては、物流面での課題が残っている。Bamlanivimab単剤療法の調達は、既に疲弊した医療機関が直面している課題を露呈させた。
この臨床試験には複数のlimitationがある。
- 非白人はたった12.6%で, 12~17歳の患者はたったの1.1%だった。
- 併存疾患のある患者の割合は、慢性腎臓病; 3.5%, 心血管系疾患; 7.4%, 慢性閉塞性肺疾患; 8.2%と少なかった。
- 背景に免疫不全がある患者の割合; 1.5%, 免疫抑制薬投与中; 4.9% と少なかった。
- 現行のbamlanivimab・etesevimab併用療法緊急使用承認は発症後10日以内の使用を指示しているが、この臨床研究では治療開始8日よりも前から症状があった患者はたった5%だった。
- この臨床試験は米国のみで実施され、今回の限定的なdata setでは判断できない、有効性に関する国ごとの違いが存在する可能性がある。
追記: 依然、一部医学生や医療関係者で沸騰中の順天堂大学医学部への某有名アスリートの裏口入学疑惑ですが、久々に私の意見をYouTube上で公開しております。私の立場は割とマイルドと思っていますが、是非ご視聴下さい。