今日はまた英語論文を紹介してみようと思います。今回参考にするのは、今年4/21に発表された論文"Safety and Efficacy of Single-Dose Ad26.COV .S Vaccine against Covid-19."(Sadoff J., Gray G. et al., N Engl J Med, 2021;384:2187-201)です。
(1) Introduction
Ad.26.COV2.Sワクチン SARS -CoV -2スパイクタンパク質の全長をencodeした遺伝子組み換え複製不能 ヒトアデノウイルス type 26(adenovirus type 26; Ad26 SARS -CoV -2 challenge studyにおいて低用量にて強い免疫を誘導し, 初期の臨床的データでは、5x10^10("^10" とはここでは『10乗』を意味する)ウイルス粒子単回投与が安全であり, 良好な液性・細胞性免疫反応を誘導したことが示された。Ad.26.COV2.Sは通常の冷凍庫で2年間, 冷凍庫の温度で3ヶ月保存可能 であることから、輸送・貯蔵・使用が簡単である。
ENSEMBLE は、Ad26.COV2.S 5x10^10ウイルス粒子単回投与の、成人におけるCOVID-19予防・SARS -CoV -2感染に対する有効性, 並びに 安全性を評価する現在進行中の第3相臨床試験 である。 今回、その臨床試験 のprimary analysisの結果を報告する。
(2)Method
①Trial Design
ENSEMBLEはアルゼンチン, ブラジル, チリ, コロンビア, メキシコ, ペルー, 南アフリカ , 米国で現在進行中の 2年間の多施設参加ランダム化二重盲検化プラセボ コントロール 第3相pivotal trialである。 非盲検的な独立データ・安全性監視委員会が安全性の監視を継続した。
この臨床研究は、スポンサーであるJanssen Research and Developement Janssen Vaccines and Prevention のaffiliateであり, Johnson&Johnson 傘下企業?であるJanssen 製薬会社の一部Operation Warp Speed Covid-19 Rapid Response Team National Institutes of Health や国防総省 ?等が参加するチーム
参加者は1:1の比率でワクチン接種群ないしプラセボ 接種群へ割り振られた。 ランダム化はinteractive Web回答システムを用いて行われ、実施場所, 年齢グループ, 併存疾患の有無により階層化された。
ワクチンないしプラセボ の接種は第1日に行われた。ワクチンはウイルス粒子濃度1x10^11/mLの単回使用バイアルとして供給され、ウイルス粒子数5x10^10の用量にて単回の筋注が行われた。
参加者は'Symptom of Infection with Coronavirus-19' 臨床試験 のスタッフは鼻腔拭い液を採取し, 検体はまず地方の研究所で、FDA が緊急使用を承認したSARS -CoV -2用RT-PCR によって検査された後、中央で検査(m-2000 SARS -CoV -2 real-time RT-PCR )が行われた。SARS -CoV -2の血清学的陽性は、SARS -CoV -2 nucleocapsid(N) immunoassayによって臨床試験 参加時, 並びに第29・71日目に行われた。
COVID-19症例が多く発生し, 中央での検査に時間が掛かったことから、primary analysis時では全ての症例が中央で検査されていたとは限らない。
②PICO
1. Participant Selection: 18~59歳の成人(Stage 1a)と60歳以上の成人(Stage 2a)の臨床試験 が並行して行われ、健康状態良好で併存疾患の無い合計2,000名が参加した。3日間のsafty reviewの後、stage 1bと2bが開始された。このstageには上記と同じ年齢層で, 併存疾患が安定している成人が追加で参加した。
2. Intervention : Ad26. COV2.Sワクチンを接種された参加者(ワクチン群 )
3. Comarison: プラセボ を接種された参加者(プラセボ 群
4. Outcome: 安全性と有効性を以下のように評価した。
1) 安全性 臨床試験 から撤退するに至った重篤 な有害事象と有害事象が試験期間中を通して記録された。約6,000名からなるsafety subpopulation 非
2) 有効性 primary end point per-protocol population (=計画通りの薬剤が投与された参加者)における、
接種後14日以降に 接種後28日以降に
である。
(3)Result
①Participants
Table 1
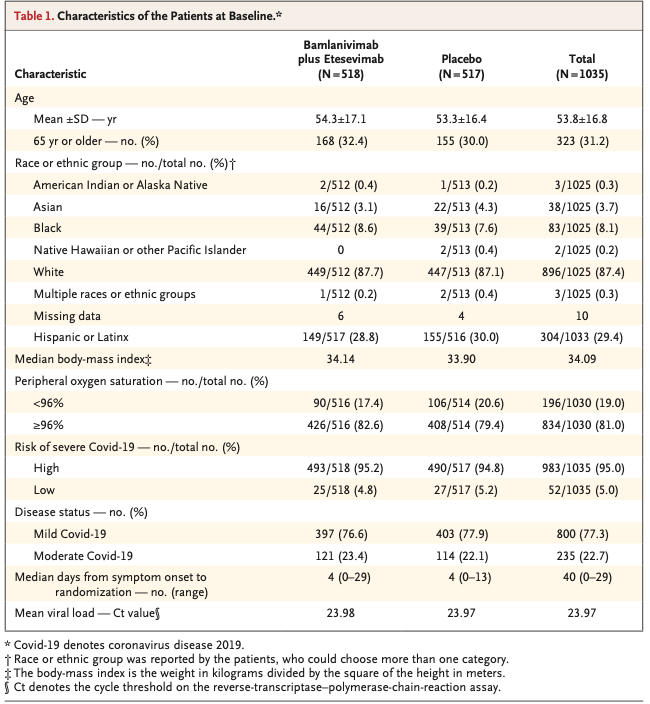
参加登録は2020年9/21に開始され、今回のanalysis用のdata-cutoff期日は2021年1/22であった。合計44,325名がランダム化され、うち43,783名 がワクチンないしプラセボ を接種された; per-protocol population には39,321名のSARS -CoV -2陰性参加者が含まれた(ワクチン群; 19,630名 , プラセボ 群; 19,691名 。参加者のbaselineの人口統計学 上の特徴や併存疾患は二群間で均衡だった(Table 1)
BaselineでSARS -CoV -2血清学的陰性だった参加者は9.6%
フォローアップ中央値は58日(range; 1~124日), フォローアップが8週間以上であった参加者は55%
60歳以上で併存疾患のある参加者の遅い参加登録は、このsubgroupにおけるフォローアップ期間短縮に繋がった。
②安全性
Fig. 1
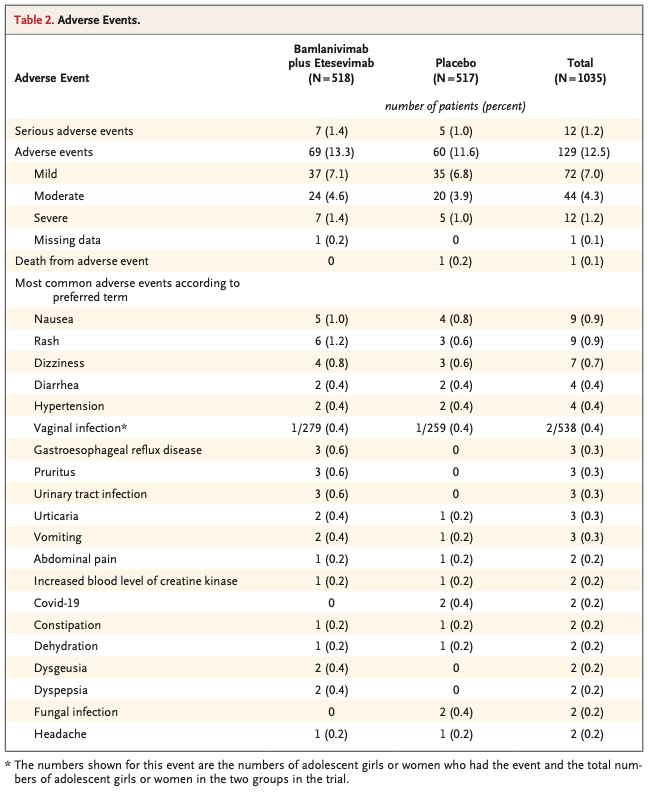
Safety subpopulation ワクチン群3,356名 とプラセボ 群3,380名プラセボ 接種後の7日間において、プラセボ 群よりもワクチン群の参加者で, そして60歳以上の参加者よりも18~59歳の参加者で非 (Fig. 1) 注射部位の疼痛 だった(48.6% ); ワクチン群で最も多い全身性過敏症は頭痛(38.9%), 疲労 感(38.2%), 筋肉痛(33.2%), 吐き気(14.2%) だった。
COVID-19関連製のものを 除く 重篤 なワクチン群21,895名中83名(0.4% ) , プラセボ 群21,88名中96名(0.4% )7つ の重篤 な有害事象は、ワクチン群におけるワクチン接種と関連していると判断された。
静脈血栓症 イベント の数的な不均衡が観察されたワクチン群; 11名 vs プラセボ 群; 3名この参加者の大半が基礎疾患及び素因を持っていた。 痙攣 (ワクチン群; 4名 vs プラセボ 群; 1名耳鳴 (ワクチン群; 6名 vs プラセボ 群; 0名これらの有害事象とAd26.COV2.Sの因果関係は不明である。
ワクチン群で3名 , プラセボ 群で16名が死亡 したが、 いずれも臨床試験 における介入と無関係と判断された。 ワクチン群でCOVID-19と関連した 死亡 0 であった一方、プラセボ 群でCOVID-19と関連した 死亡 5名 脳出血 を伴う横静脈洞血栓症 とギランバレー症候群が見られたワクチン群参加者はそれぞれ1名であった。
③有効性
Table 2
Per-protocolのriskありpopulationにおいて、接種後14日以降に 症候性COVID-19 症例 (中央の検査で診断)は468名であり、うち464名が中等症〜重症・致死的 であった ( ワクチン群; 166名 vs プラセボ 群; 348名)。 ワクチン有効性は66.9% (調整後95%CI 59.0~73.4) であった (Table 2) 。 接種後28日以降に 発症したprimary endo point 、 中等症〜重症・致死的 COVID-19症例数 が ワクチン群で66名 , プラセボ 群で193名であり、 ワクチン有効性は66.1% (調整後95%CI 55.0~74.8) だった (Table 2) 。
Fig.2 A, B, and C
Table 3
中等症〜重症・致死的 COVID-19初回発症の累積罹患率 は、ワクチンorプラセボ 接種後のおよそ14日以降から (Fig. 2A) (Table 2) 。この不均衡はおそらく、フォローアップ期間の違いもしくはsubgroupの小さなサンプルサイズによるものと思われる。 2つのprimary end pointの解析と, 中央の検査で診断されたCOVID-19症例というsecondary end pointにおけるワクチン有効性の推定値は、全ての陽性症例の解析における推定値と2%未満の差があり, 信頼区間 も類似していた(Table 2 and 3 ) 。完全な解析セットにおけるワクチン有効性推定値は、全般的にper-protocol populationのそれよりも低かった。
重症・致死的 COVID-19に関しては 、
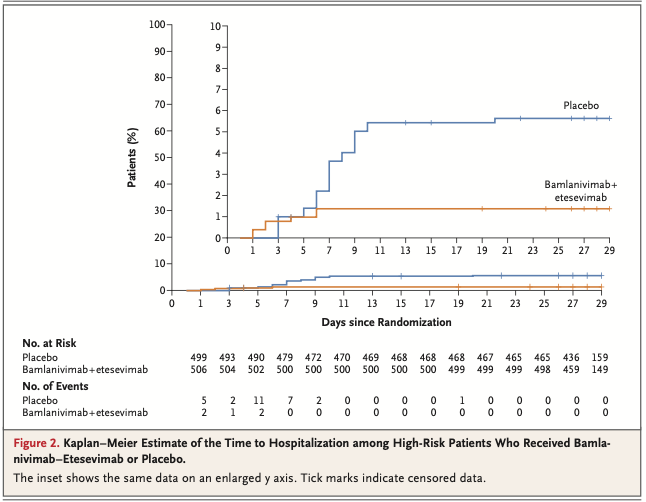
接種後14日以降に 76.7% (調整後95%CI 54.6~89.1) 接種後28日以降に 85.4% (調整後95%CI 54.2~96.9) 累積罹患曲線は接種後7日ぐらいから 分離 (Fig. 2B)
無 症候性感染 に対するワクチン有効性71日目でN-immunoassay結果が分かったのはたった2,650名であり、そのためpreliminary analysisしか行えなかった。 ワクチン群で18名 , プラセボ 群で50名ワクチン有効性 65.5% ; 95%CI 39.9~81.1 )。
また入院 については、
接種後14日以降に 入院 : ワクチン群; 2名 vs プラセボ 群; 29名ワクチン有効性 93.1% (95%CI 72.7~99.2) 接種後28日以降に 入院 : ワクチン群; 0 vs プラセボ 群; 16名ワクチン有効性 100% (95%CI 74.3~100.0)
という結果であった。
中等症COVID-19に罹患した参加者のうち、ワクチン群参加者は4~6個の症状を訴えることが多かった が、プラセボ 群では7~9個'Symptoms of Infection with Coronavirus-19' アンケート
発症後1日目では、ワクチン群がプラセボ 群よりも24%(95%CI -1~46)低かった
発症後7日目では、ワクチン群がプラセボ 群よりも47%(95%CI 23~66)低かった
発症後14日では、ワクチン群がプラセボ 群よりも53%(95%CI 0~81)低かった
重症・致死的 COVID-19に対する有効性の推定値は、各国の間で一致して高かった(Table 3) SARS -CoV -2に感染した参加者から得た唯一の("unique")RT-PCR 陽性検体512個に由来する、中間配列解析データに基づいた知見は以下の通りである。
米国: 基準配列(D614G変異を含むWuhan-Hu-1)が優勢(197配列中190[96.4%])
南アフリカ 20H/501Y.V2変異型 B.1.351 ベータ 91配列中86[94.5% ] )ブラジル : 基準配列; 124配列中38(30.6%), E484K変異 のある基準配列P.2系統 , またはガンマ 124配列中86(69.4% )
南アフリカ 及び この臨床試験 のCOVID-19症例におけるベータ変異型 の流行にも関わらず、ワクチン有効性は維持された14日以降に 中等症〜重症・致死的 COVID-19に対して52.0% , 重症・致死的 COVID-19に対して73.1% ; ワクチン接種後28日以降に 中等症〜重症・致死的 COVID-19に対して64.0% , 重症・致死的 COVID-19に対して81.7% )(Fig. 2C and Table 3) 。南アフリカ では、ワクチン接種後28日以降に発症したCOVID-19による入院はワクチン群で0名 , プラセボ 群で6名南アフリカ では、COVID-19関連死亡例5名全員がプラセボ 群であった。
性別, 人種に従って定義した subgroupにおいて、ワクチン有効性の有意義な差は見られなかった。接種後28日以降に 併存疾患のある60歳以上の参加者でワクチン有効性の点推定値の低下 が見られた中等症〜重症・致死的 COVID-19症例数: ワクチン群; 15名 vs プラセボ 群; 26名接種後14日以降に 見られなかった中等症〜重症・致死的 COVID-19症例数: ワクチン群; 22名 vs プラセボ 群; 63名60歳以上で併存疾患のある参加者の入院は、 ワクチン群で2名 , プラセボ 群で11名ワクチン有効性 81.6% ; 95%CI 15.8~98.0
(4)Disucussion
国際的な第3相臨床試験 ENSEMBLEは、Ad26.COV2.Sワクチン単回接種がCOVID-19予防に有効であると示した。 接種後14日以降に発症した中等症〜重症・致死的COVID-19への有効性は67%, 接種後28日以降に発症したそれへの有効性は66%だった。接種後14日以降に発症した重症・致死的COVID-19への有効性は77%, 接種後28日以降に発症したそれへの有効性は85%であり、重症・致死的COVID-19へのより高い有効性が観察された。
中等症〜重症・致死的COVID-19に対する効果の発現は接種後14日目まで, 重症・致死的に対する効果の発現は接種後7日目までに明らかとなった。有効性の増加は、特に重症・致死的に関しては接種後約8週間後まで持続した。11週間フォローされた3,000名, または 15週間フォローされた1,000名において、効果減弱の証拠は認められなかった。 これは第1・2a相臨床試験 で観察された液性免疫持続と矛盾しない。
重症・致死的COVID-19に対する有効性は、全体, 並びに 参加各国で一致して高かった。 これは重症COVID-19が各個人, 及び 医療態勢に与える影響が最も多い為、特に重要である。接種後14日以降に発症したCOVID-19による入院に対する有効性は93%, 接種後28日以降に発症したCOVID-19による入院に対する有効性は100%であった。入院はその地域の実践や資源の入手可能性に影響されるものの、報告された入院は全て明確な臨床所見によって正当化されており, 各国で一致していた。加えて、各国でワクチン群とプラセボ 群双方へ同じmanagementが行われたはずである。プラセボ 群ではCOVID-19と関連した死亡が5名だったが、ワクチン群では0であった。死亡率の減少と入院に対する高い有効性は、各個人でのCOVID-19の影響を顕著に減らし, 尚且つ 医療態勢への負荷を劇的に減らすと期待されている。
ワクチン接種にも関わらずCOVID-19に感染した参加者は、プラセボ 被接種者よりも少ない・軽症の症状を報告しており、これはワクチン接種後に病勢が軽くなることを示唆している。 血清学的に診断した無症候性感染へのAd26.COV2.Sの予防効果は66%以上とpreliminary analysisで示されている。症候性及び無症候性感染発症に対する効果は、ワクチンが地域内感染("community-wide transmission)を減らすのに有効である可能性を示唆している。
スパイクタンパク質のN-terminalと受容体結合ドメイン (中和抗体の標的として知られている; 特にE464K変異は中和感受性の減少と関連している)の変異があるSARS -CoV -2の新系統が出現している。 この臨床試験 では、アフリカのCOVID-19症例のうち配列解析が行われた症例の95%がベータ変異型, ブラジルのCOVID-19症例のうち配列解析が行われた症例の69%がガンマ変異型だった。しかしながら、variants of concernの高度な流行にも関わらず、ワクチン有効性は高値を維持した。 この知見は、従来のWuhan-Hu-1系統に基づくCOVID-19ワクチンが南アフリカ ・ブラジルで発生した新規変異型に対する交差免疫効果を発揮可能であることを示している。 Ad26.COV2.Sは人体内で、SARS -CoV -2に対してFcを介した機能を持つ抗体を誘導し, これらのFc機能あり抗体は、新規変異型に対する能力低下を示さなかった。 加えて、第1・2a相試験ではSARS -CoV -2スパイクタンパク質に対するCD8+T細胞反応が見られた。免疫情報学的分析によると、SARS -CoV -2変異型の間でT細胞epitopeが保持されていたことが示された。 これらの要素が南アフリカ における重症・致死的COVID-19, 入院, 死亡に対する高い有効性へ寄与したと思われる。
若年者と高齢者, そして 併存疾患のある参加者とない参加者の間で、症候性感染への有効性は類似していた。 60歳以上参加者が参加するsubgroupの解析は、接種後14日以降に発症した症候性COVID-19に対する有効性が、併存疾患有無に従って定義したsubgroupのそれと類似していることを示した。接種後28日以降に発症したCOVID-19に関しては、併存疾患の無い参加者のワクチン有効性が、併存疾患がある参加者より低かった。この知見は、このsubgroupにおける少ない症例と短いフォローアップによる不正確さに帰することができる。加えて、Kaplan-Meir曲線は併存疾患のある60歳以上のワクチン被接種参加者内の累積罹患率 が臨床研究参加者全体のそれと類似していることを示しており、ワクチン有効性が類似していることを示唆している。 併存疾患のある60歳以上のワクチン被接種参加者における入院に対するワクチン有効性は82%であり、この結果と矛盾しない。
この臨床試験 は、Ad26.COV2.Sが容認できる安全性・過敏症profileを有していることを示した第1・2a相試験の知見を確定するものである。 Ad26.COV2.Sの過敏症は一過性で、高齢者より若年者で多く, 急速に消退した。重症過敏症は少なく, 重篤 な有害事象は稀であった。
この臨床試験 の主要なstrength この臨床試験 が倫理的・地理的に広大なpopulationでワクチンの有効性を示したこと limitation この臨床試験 のフォローアップ期間が比較的短いこと データは予防効果の減弱を示唆していない。最初のAd26.COV2.S被接種参加者の結果とプラセボ 被接種者(protocol修正が承認された後にはAd26.COV2.S接種を受ける予定)の結果を比較する為の、長期的な非盲検化フォローアップが計画されている。